Toplotna provodljivost
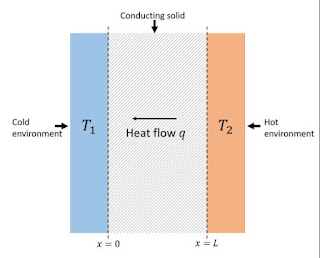
P rosta definicija toplotne provodljivosti Toplotna provodljivost Toplotna provodljivost je u fizici skalarna veličina (k) koja opisuje sposobnost substance da provodi toplotu. Što je toplotna provodljivost veća, to se veća količina toplote može preneti kroz isti poprečni presek, u istom vremenu. Pojavljuje se prvenstveno u Fourierovom zakonu kondukcije (1822. godina, Theorie Analytique de la chaleur - Analitička teorija toplote). Na osnovu Videman Francovog zakona, dobri električni provodnici su i dobri toplotni provodnici. Za metale specifična električna provodljivost je uporediva sa toplotnom provodljivosću, zbog toga što su slobodni elektroni koji se nalaze u velikom broju u nekim metalima zaslužni kako za električni, tako i za toplotni transport. Da bi se razumele varijacije toplotne provodljivosti na niskim temperaturama, mora se obratiti pažnja na različite mehanizme transporta energije kroz materijal. Postoje tri bazična mehanizma odgovorna za prenos toplote kroz materija